3.3.1 Estructura y propiedades de los líquidos. Modelo cinético molecular de los líquidos:
a)ESTRUCTURA
La diferencia entre la estructura de los gases, líquidos y sólidos se puede entender fácilmente si se comparan las densidades de las sustancias. En el caso de líquidos, su densidad es 800 veces más grande que la de los gases.
La figura muestra un modelo para la estructura de un líquido:
b) PROPIEDADES
COMPRESIÓN Y EXPANSIÓN
A los líquidos se les considera incomprensibles debido que dentro de ellos existen fuerzas extremas que entre sus moléculas las cuales se atraen, por otra parte cuando a un liquido se le aplica una presión su volumen no se ve afectado en gran cantidad, ya que sus moléculas tienen poco espacio entre si; por otra parte si aplicamos un cambio de temperatura a un líquido su volumen no sufrirá cambios considerables. Cabe señalar que cuando las moléculas de un líquido están en continuo aumento de movimiento es por causa del aumento de alguna temperatura que esté experimentando el mismo lo cual inclina al liquido a aumentar la distancia de sus moléculas, a pesar de esto las fuerzas de atracción que existen en el líquido se oponen a ese distanciamiento de sus moléculas. Al realizar la mezcla de dos líquidos, las moléculas de uno de ellos se difunde en todas las moléculas del otro liquido a mucho menor velocidad, cosa que en los gases no sucede. Sí deseamos ver la difusión de dos líquidos, se puede observar dejando caer una pequeña cantidad de tinta (china) en un poco de agua. Debido a que las moléculas en ambos líquidos están muy cerca, cada molécula conlleva una inmensidad de choques antes de alejarse, puede decirse que millones de choques. La distancia promedio que se genera en los choques se le llama trayectoria libre media y, en los gases es mas grande que en los líquidos, cabe señalar que esto sucede cuando las moléculas están bastantemente separadas. A pesar de lo que se menciona anteriormente hay constantes interrupciones en sus trayectorias moleculares, por lo que los líquidos se difunden mucho mas lentamente que los gases.
En un liquido, las fuerzas de atracción son suficientemente agudas para limitar a las moléculas en su movimiento dentro de un volumen definido, a pesar de esto las moléculas no pueden guardar un estado fijo, es decir que las moléculas del líquido no permanecen en una sola posición. De tal forma que las moléculas, dentro de los limites del volumen del liquido, tienen la libertad de moverse unas alrededor de otras, a causa de esto, permiten que fluyan los líquidos. Aún cuando, los líquidos poseen un volumen definido, pero, debido a su capacidad para fluir, su forma depende del contorno del recipiente que los contiene. Algunos líquidos, literalmente fluyen lentamente, mientras que otros fluyen con facilidad, la resistencia a fluir se conoce con el nombre de viscosidad. Si existe una mayor viscosidad, el liquido fluye mas lentamente. Los líquidos como la maleza y el aceite de los motores son relativamente viscosos; el agua y los líquidos orgánicos como el tetracloruro de carbono no lo son. La viscosidad puede medirse tomando en cuenta el tiempo que transcurre cuando cierta cantidad de un liquido fluye a través de un delgado tubo, bajo la fuerza de la gravedad. En otro método, se utilizan esferas de acero que caen a través de un liquido y se mide la velocidad de caída. Las esferas mas lentamente en los líquidos mas viscosos.
MODELO CINÉTICO MOLECULAR DE LOS LÍQUIDOS
El modelo nos da una descripción microscópica en contraste con la descripción macroscópica que se obtiene por medio de los sentidos.
El modelo que explica los estados de agregación y los cambios de estado es el MOLECULAR. Sólo si pensamos que la materia esta compuesta de pequeñas partículas, a las que nombramos moléculas, explicarremos de manera sencilla y lógica no sólo las propiedades de forma y volumen sino todas las propiedades.
Si las partículas son iguales la única explicación en que en cada estado las partículas se disponen de manera diferente.
Las partículas de los sólidos se encuentran muy próximas, y las fuerzas de atracción entre ellas son muy intensas, su único movimiento es el de vibración.
 Las partículas de los líquidos vibran y forman conglomerados que se desplazan unos respecto a otros.
Las partículas de los líquidos vibran y forman conglomerados que se desplazan unos respecto a otros.

Las partículas de los gases se encuentran muy separadas entre sí, y se mueven a grandes velocidades, prácticamente libres de fuerzas de atracción.

La temperatura es una medida de la energía cinética media de las partículas de un cuerpo.
(Modelo Cinético Molecular de los líquidos)
3.3.2 Propiedades del agua
PUNTOS DE FUSIÓN EBULLICIÓN
El punto de fusión es la temperatura a la cual la materia pasa de estado sólido a estado líquido, es decir, se funde.
Al efecto de fundir un metal se le llama fusión (no podemos confundirlo con el punto de fusión). También se suele denominar fusión al efecto de licuar o derretir una sustancia sólida, congelada o pastosa, en líquida.
El punto de ebullición es aquella temperatura en la cual la materia cambia de estado líquido a gaseoso, es decir se ebulle. Expresado de otra manera, en un líquido, el punto de ebullición es la temperatura a la cual la presión de vapor del líquido es igual a la presión del medio que rodea al líquido. En esas condiciones se puede formar vapor en cualquier punto del líquido.
La temperatura de una sustancia o cuerpo depende de la energía cinética media de las moléculas. A temperaturas inferiores al punto de ebullición, sólo una pequeña fracción de las moléculas en la superficie tiene energía suficiente para romper la tensión superficial y escapar. Este incremento de energía constituye un intercambio de calor que da lugar al aumento de la entropía del sistema (tendencia al desorden de las partículas que lo componen).
El punto de ebullición depende de la masa molecular de la sustancia y del tipo de las fuerzas intermoleculares de esta sustancia.
DENSIDAD.
La densidad o densidad absoluta es la magnitud que expresa la relación entre la masa y el volumen de un cuerpo.
La densidad relativa está definida como el cociente entre la densidad de una sustancia y la de otra sustancia tomada como referencia, resultando
ρr=ρ0/ρ
donde ρr es la densidad relativa, ρ es la densidad absoluta y ρ0 es la densidad de sustancia.
Para los líquidos y los sólidos, la densidad de referencia habitual es la del agua líquida a la presión de 1 atm y la temperatura de 4 °C. En esas condiciones, la densidad absoluta del agua es de 1000kg/m3, es decir, 1kg/L.
CAPACIDAD CALORIFICA
La capacidad calorífica de un cuerpo es el cociente entre la cantidad de energía calorífica transferida a un cuerpo o sistema en un proceso cualquiera y el cambio de temperatura que experimenta.
El agua tiene el segundo índice más alto de capacidad calorífica específica así como una elevada entalpía de vaporización ; ambos factores se deben al enlace de hidrógeno entre moléculas. Estas dos inusuales propiedades son las que hacen que el agua "modere" las temperaturas terrestres, reconduciendo grandes variaciones de energía.
CALORES LATENTES DE FUSION Y DE EVAPORACIÓN
Calor latente de fusión o calor de cambio de estado, es la energía absorbida por las sustancias al cambiar de estado, de sólido a líquido (calor latente de fusión) o de líquido a gaseoso (calor latente de vaporización). Al cambiar de gaseoso a líquido y de líquido a sólido se devuelve la misma cantidad de energía.
Cuando se aplica calor al hielo, va ascendiendo su temperatura hasta que llega a 0°C (temperatura de cambio de estado), a partir de entonces, aun cuando se le siga aplicando calor, la temperatura no cambia hasta que se haya fundido del todo. Esto se debe a que el calor se emplea en la fusión del hielo.
Una vez fundido el hielo la temperatura volverá a subir hasta llegar a 100°C; desde ese momento se mantendrá estable hasta que se evapore toda el agua.
Esta cualidad se utiliza en la cocina, en refrigeración, en bombas de calor y es el principio por el que el sudor enfría el cuerpo.
Todo líquido tiene una temperatura a la que comienza a evaporase.
Cuando se entrega energía en forma de calor al líquido, ésta energía se utiliza para aumentar la temperatura del mismo. Cuando alcanza la temperatura de vaporización, la energía se utiliza para el cambio de estado de líquido a gaseoso, pero esta transformación no es istantanea. En ese momento estamos en presencia de vapor húmedo. La energía que se sigue entregando hace que el vapor se vaya secando hasta la humedad 0, en ese instante hay vapor seco. La energía que se entregó en Kcal (kilocalorías) para secar el vapor, por unidad de masa es lo que se llama calor latente de vaporización, y esta unidad es singular para cada líquido, como lo es el peso específico.
Por ejemplo si se calienta agua, cuando ésta llega a 100 °C comienza a evaporarse, aunque sigamos entregando calor, éste va a hacer que el agua se evapore por completo, pero la temperatura se mantendrá siempre a 100°C, cuando se haya evaporado toda el agua y si seguimos calentando, recién ahí comenzará de nuevo a subir la temperatura.
La energia entregada desde que el agua llegó a 100°C hasta que comienza de nuevo a subir la temperatura, dividido la masa de agua sería el calor latente de vaporización.
Agua: - de fusión: 333,9 kJ/kg (79,9 kcal/kg) a 0 ºC;
- de vaporización: 2253 kJ/kg (539 kcal/kg) a 100 ºC.
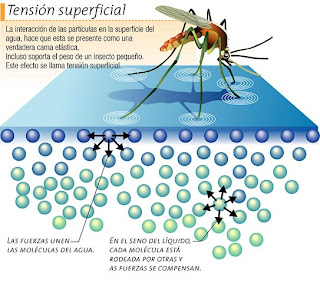
TENSIÓN SUPERFICIAL
En física se denomina tensión superficial de un líquido a la cantidad de energía necesaria para aumentar su superficie por unidad de área. Esta definición implica que el líquido tiene una resistencia para aumentar su superficie.
La tensión superficial (una manifestación de las fuerzas intermoleculares en los líquidos), junto a las fuerzas que se dan entre los líquidos y las superficies sólidas que entran en contacto con ellos, da lugar a la capilaridad.Fuerza que actúa tangencialmente por unidad de longitud en el borde de una superficie libre de un líquido en equilibrio y que tiende a contraer dicha superficie. en pocas palabras la elevación o depresión de la superficie de un liquido en la zona de contacto con un solido.
PODER DISOLVENTE
La estructura de la molécula de agua la hace capaz de actuar como un disolvente poderoso de muchas sustancias. Si se introduce un cristal de cloruro de sodio en agua, las moléculas de agua rodean a los iones de sodio y cloro, atrayéndolos por sus extremos negativos o positivos, respectivamente.
El movimiento de las moléculas de agua arrastra a los iones que se dispersan por ella, formando una disolución de cloruro de sodio en agua. Ello hace que en la naturaleza exista un enorme número de disoluciones acuosas.
3.3.3 Composisión del agua
ELECTRÓLISIS
La electrólisis del agua es la descomposición de agua (H2O) en gas de oxígeno (O2) e hidrógeno (H2) por medio de una corriente eléctrica a través del agua. Este proceso electrolítico es raramente usado en aplicaciones industriales debido a que el hidrógeno puede ser producido a menor coste por medio de combustibles fósiles.
SÍNTESIS
La síntesis orgánica en agua comprende aquellos procesos de formación de compuestos de esqueleto hidrocarbonado que se llevan a cabo en medio acuoso. Tradicionalmente las reacciones orgánicas se han desarrollado en disolventes orgánicos (metanol, diclorometano, tolueno, etc.) debido a la insolubilidad de muchos de los reactivos en medio acuoso. Este tipo de disolventes, especialmente los disolventes clorados, es una fuente importante de emisiones de compuestos orgánicos volátiles (COV) a la atmósfera, causantes del fenómeno de smog en las ciudades.
3.3.4 Estructura molecular del agua
ENLACES COVALENTES
Un enlace covalente se produce por compartición de electrones entre dos o mas átomos. Este tipo de enlace se produce cuando existe electronegatividad polar pero la diferencia de electronegatividades entre los átomos no es suficientemente grande como para que se efectúe transferencia de electrones. De esta forma, los dos átomos comparten uno o más pares electrónicos en un nuevo tipo de orbital, denominado orbital molecular. Los enlaces covalentes se suelen producir entre elementos gaseosos no metales.
A diferencia de lo que pasa en un enlace iónico, en donde se produce la transferencia de electrones de un átomo a otro, en el enlace químico covalente, los electrones de enlace son compartidos por ambos átomos. En el enlace covalente, los dos átomos no metálicos comparten uno o más electrones, es decir se unen a través de sus electrones en el último orbital, el cual depende del número atómico en cuestión. Entre los dos átomos puede compartirse uno, dos o tres electrónes, lo cual dará lugar a la formación de un enlace simple, doble o triple. En representación de Lewis estos enlaces pueden representarse por una pequeña línea entre los átomos.

MOLECULAS POLARES
Los enlaces formados por átomos distintos con grandes diferencias de electronegatividad, forman moléculas polares. La molécula es eléctricamente neutra en su conjunto por tener igual de partículas positivas y negativas, pero no existe simetría en la distribución de la electricidad.
Aquellas moléculas cuyos centros de cargas positiva no coinciden con la carga negativas, se denomina moléculas polares, llamándose polar al enlace en el cual un par de electrones de la configuración electrónica externa no está igualmente compartido por los dos átomos.
De este modo, tanto los enlaces iónicos, como los enlaces covalentes pueden formar moléculas polares.
MOLECULAS NO POLARES Cuando se forman en un enlace covalente entre átomos iguales, la molécula es neutra es decir, tiene carga eléctrica cero; por ejemplo: H2, O2, Cl2.
En este tipo de enlace no hay cambio en el número de oxidación de los átomos debido a que sus electrones compartidos son equidistantes.
PUENTES DE HIDROGENO
El puente de hidrógeno es un enlace que se establece entre moléculas capaces de generar cargas parciales. El agua, es la sustancia en donde los puentes de hidrógeno son más efectivos, en su molécula, los electrones que intervienen en sus enlaces, están más cerca del oxígeno que de los hidrógenos y por esto se generan dos cargas parciales negativas en el extremo donde está el oxígeno y dos cargas parciales positivas en el extremo donde se encuentran los hidrógenos. La presencia de cargas parciales positivas y negativas hace que las moléculas de agua se comporten como imanes en los que las partes con carga parcial positiva atraen a las partes con cargas parciales negativas. De tal suerte que una sola molécula de agua puede unirse a otras 4 moléculas de agua a través de 4 puentes de hidrógeno. Esta característica es la que hace al agua un líquido muy especial.
PUENTES DE HIDROGENO EN EL AGUA
Los puentes de Hidrógeno, se forman por átomos de Hidrógeno localizados entre átomos electronegativos. Cuando un átomo de Hidrógeno está unido covalentemente, a una átomo electronegativo.
3.3.5 Regulación del clima
En la regulación del clima global participan todos los sistemas de la naturaleza: la atmósfera y la hidrosfera (sobre todo los océanos), la criosfera (hielo, nieve), la litosfera (la corteza terrestre) y la biosfera. En las últimas décadas, también el ser humano (como causante del aumento en la emisión de gases de efecto invernadero, como el dióxido de carbono y el metano) se ha convertido en un factor que afecta al clima.
En el sistema climático de la Tierra, el mar cumple una función primordial. La elevada capacidad calórica del agua marina y las particularidades de su balance térmico, como la mezcla de las capas superiores, amortiguan las diferencias de temperatura a lo largo del año. Tanto el sistema de circulación general de la atmósfera como el de los océanos contribuyen, en proporciones similares, al equilibrio térmico entre las latitudes altas y bajas.
Además, los océanos influyen sobre el clima no sólo térmicamente, sino también como parte de los grandes ciclos biogeoquímicos, especialmente el ciclo del carbono que, en forma de dióxido de carbono, es fundamental para la futura evolución del clima. Quien quiera saber hoy cómo será el clima mañana, no puede ignorar los océanos